化学键
一切化学结构的基础
化学键是化学中的重要概念。原子通过共价化学键结合成分子,正负离子通过离子键结合成离子晶体,金属原子通过金属键形成金属晶体。这些化学键都与电子相关。但值得一提的是,在电子发现之前就出现过一些早期的化学键理论。例如,牛顿曾经在《光学》(Opticks)中指出:“(组成物质的)粒子之间存一定的吸引力,当粒子非常靠近时作用力十分强大,当粒子间的距离很小时可以发生化学反应,当距离稍远时作用力将变得微乎其微。”
在波尔提出量子原子模型之后,最有影响力的化学键理论是路易斯在1916年提出的以八电子规则为核心的化学键理论。根据该规则,他成功的解释了离子化合物之间的相互作用(离子键),并首次提出共享电子对和共价键的概念。共享电子对和路易斯结构式作为实用化学工具沿用至今。另外,在路易斯理论上发展起来的价层电子对互斥理论(VSEPR)可以非常直观的预测简单化合物的立体结构。
量子力学的建立促进了化学键理论的快速发展。价键理论(VB),原子轨道线性组合理论(LCAO),杂化轨道理论,密度函数理论(DFT)等从不同角度揭示了化学键的性质。随着计算机性能的快速提升,依据这些理论编写的计算机软件已成为化学家研究物质结构和性质的重要工具。例如,化学家可以在电脑上模拟化学键的形成和断裂,为化学实验提供理论解释和参考。
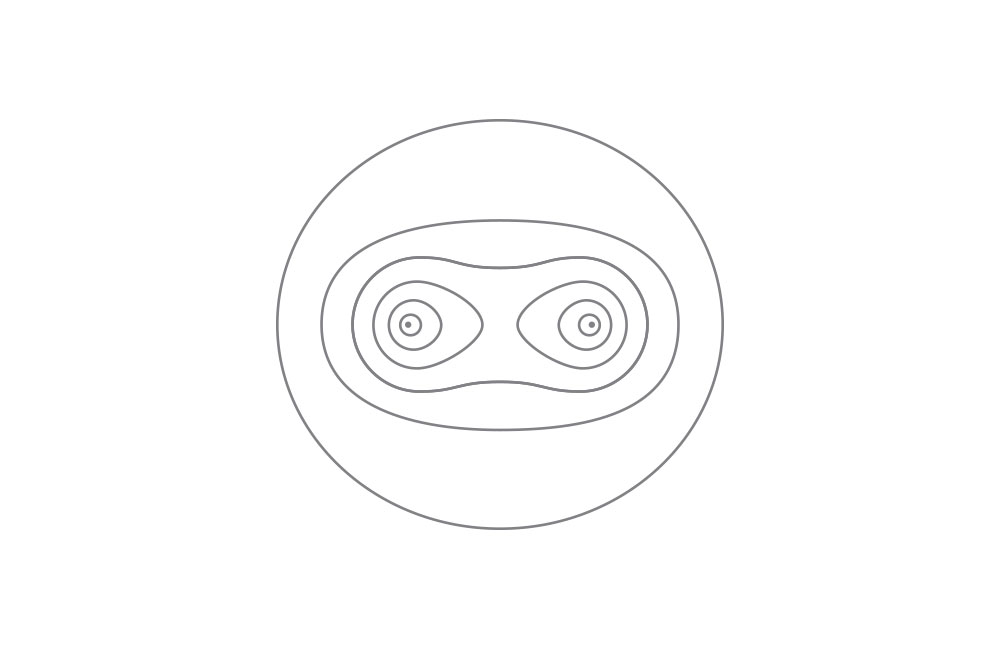
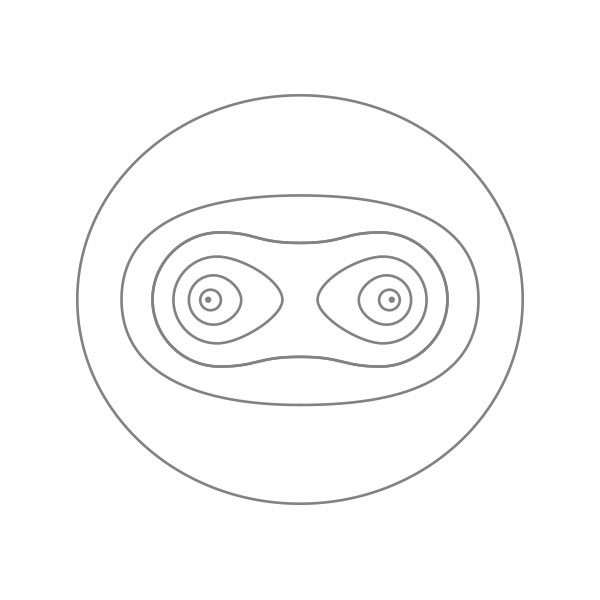
上图:氢分子电子密度分布。参考文献:London, F. Zeitschrift für Physik 46, 455 (1928)。
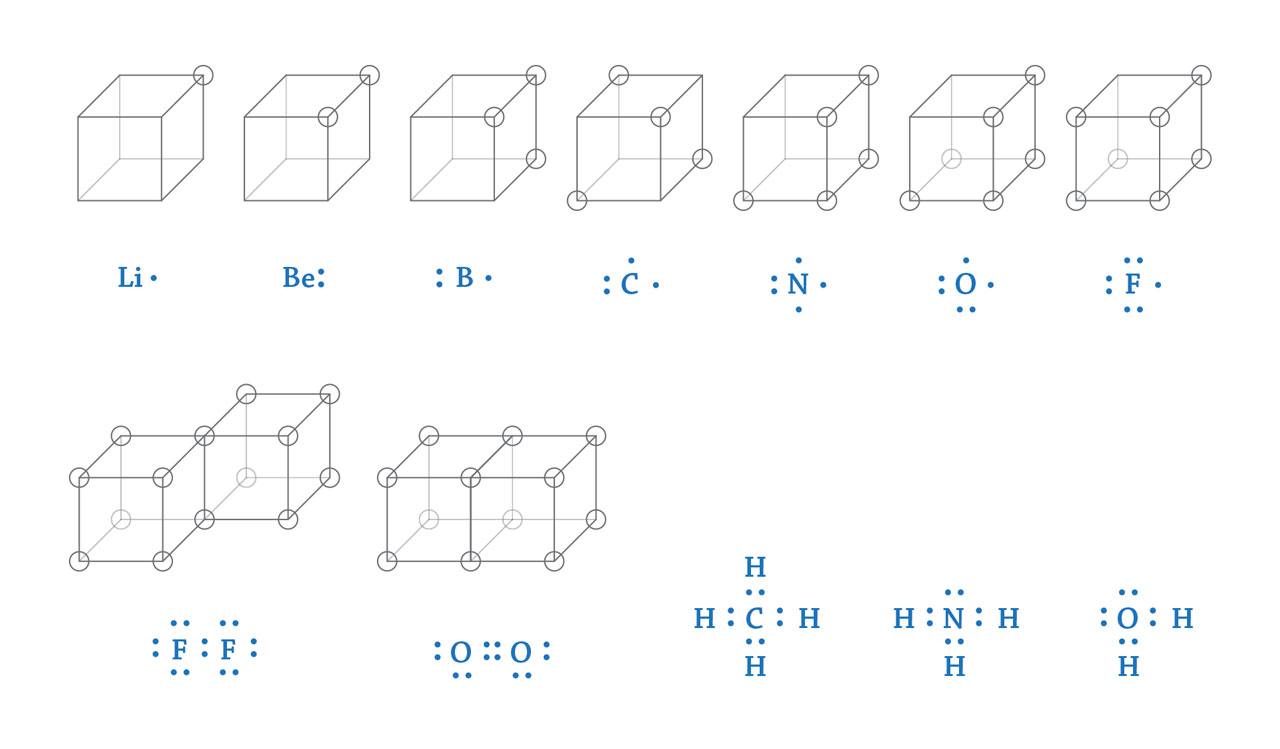
第一行从左至右:锂,铍,硼,碳,氮,氧,氟。
第二行从左至右:氟分子,氧分子,甲烷分子,氨分子,水分子。
路易斯化学键理论。1916年,路易斯提出了符合波尔原子模型的化学键理论。为了便于理解,他将原子的外层电子放在立方体的顶点上;当立方体的8个顶点都没有电子或全部被电子占据时,得到稳定的原子结构。这样外层只有1个电子的锂原子可以将电子转移给外层有7个电子的氟原子,从而得到外层没有电子的锂正离子和外层有8个电子的氟负离子,两者形成稳定的离子化合物氟化锂(LiF)。类似的,外层有6个电子的氧原子需要和两个锂原子结合,每个锂原子向氧原子转移一个电子,形成离子化合物氧化锂(Li2O)。共价化合物可以通过共享立方体的一条边(如两个氟原子)或立方体的一个面(如两个氧原子)的方式,分别形成单键或双键,使每个原子都达到稳定结构。在1916年的论文中,路易斯也同时给出了一种在元素符号周围用小点表现外层电子排布的结构式(上图蓝色),并用共享的电子对表示共价键。这种结构式后来被称作路易斯结构式,作为讲解化学键的有效工具仍在化学教科书中被广泛使用。【绘图依据:Lewis, G. N. J. Am. Chem. Soc. 38, 762 (1916)】
第一行从左至右:AB2,AB3,AB4。
第二行从左至右:AB5,AB6,AB6。